Если в объеме находится смесь из К химически не взаимодействующих газов, то для определения давления смеси рсм необходимо подсчитать сумму:

уравнение для расчета давления газа примет вид




Сравнивая (1.7) и (1.8), можно записать
Последнее выражение известно под названием закона Дальтона и формулируется следующим образом: общее давление смеси химически не взаимодействующих газов равно сумме парциальных давлений компонентов смеси.
а средняя кинетическая энергия молекул
Уравнение (1.10) известно под названием уравнения газового состояния. Оно Связывает между собой три основ-
ных параметра состояния газа: давление, молекулярную концентрацию и температуру.
Постоянная k называется постоянной Больцмана, и ее экспериментальное значение равно 1,38-10—23 Дж/К-
Уравнение (1.10) можно представить также в другой записи:

где М — молекулярная масса газа; V — объем газа; R—универсальная газовая постоянная, (?=£АГЛ=8,31-103 Дж/(К-моль), Л^а — число Авогадро, ЛГА=Л1/т=6,02-1026 кмоль-1.
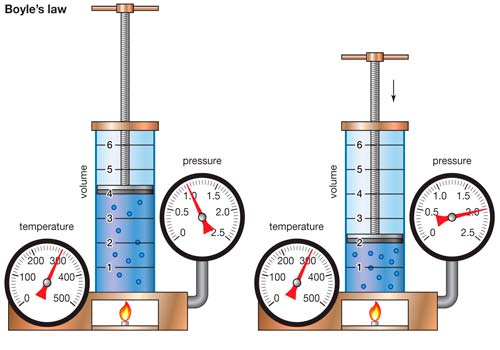
Следствием (1.10) или (1.12) является то, что при постоянной массе и неизменном давлении объем газа пропорционален его абсолютной температуре (закон Гей-Люсака). Если же постоянны масса газа и его объем, то давление газа пропорционально его абсолютной температуре (закон Шарля). При постоянных массе и температуре газа произведение его давления на объем остается неизменным (закон Бойля — Мариотта). При постоянном давлении и температуре газа молекулярная концентрация не зависит от рода газа (закон Авогадро).