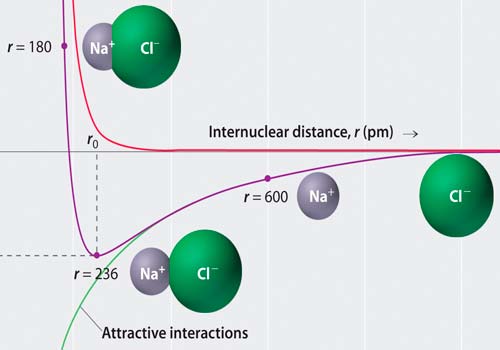
Энергия взаимодействия
По мере снижения рабочего давления роль поверхностных явлений при получении и измерении вакуума непрерывно возрастает, Развитие откачных устройств и повышение точности измерений давления в области сверхвысокого вакуума невозможны без изучения сорбционных процессов на границе газ — твердое тело.
Процесс поглощения газов или паров твердыми телами независимо от того, происходит он на поверхности или в объеме твердого тела, называется сорбцией, а процесс поглощения газов на поверхности твердых тел — адсорбцией. Различают физическую адсорбцию и хемосорбцию. Энергия взаимодействия молекул газа с поверхностью при физической адсорбции значительно меньше, чем при хемосорбции. Абсорбция —это поглощение газов в объеме твердых тел. В процессе абсорбции происходит растворение газа в объеме твердого тела.
Вещество, поглощающее газ, называется сорбентом (адсорбентом, абсорбентом), а поглощаемое вещество — сорбатом (адсорбатом, абсорбатом). Выделение газов из твердого тела называется десорбцией.
Сорбция — процесс экзотермический. При поглощении молекул газа выделяется энергия сорбционного взаимодействия, имеющая физическую и химическую природу.
Физическая составляющая энергии взаимодействия определяется несколькими эффектами, обеспечивающими притяжение и отталкивание молекул.
Индукционный эффект притяжения при взаимодействии постоянного и индуцированного диполей имеет место, когда хотя бы одна из взаимодействующих молекул обладает постоянным дипольным моментом. Ориентационный эффект притяжения наблюдается для двух вращающихся молекул с постоянными дипольными моментами. Дисперсионный эффект притяжения объясняется взаимодействием флуктуирующих диполей, которые создаются электронами, вращающимися вокруг ядра.
Энергию притяжения при физическом взаимодействии можно рассчитать по формуле где г — расстояние между молекулами; — дипольный момент молекулы; ао — поляризуемость; 1 — потенциал ионизации.
Порядок слагаемых в (2.1) соответствует последовательно энергии притяжения индукционного, ориентационного и дисперсионного эффектов взаимодействия. Величины этих эффектов для двуу одинаковых молекул представлены в табл. 2.1.
Для полярных молекул Н2О и NH3 существенную часть всей энергии взаимодействия составляет ориентационный эффект. Неполярные молекулы взаимодействуют только за счет дисперсионного эффекта, возрастающего с увеличением атомного числа. Индукционный эффект мал для всех рассматриваемых молекул.
Энергия притяжения при физическом взаимодействии обратно
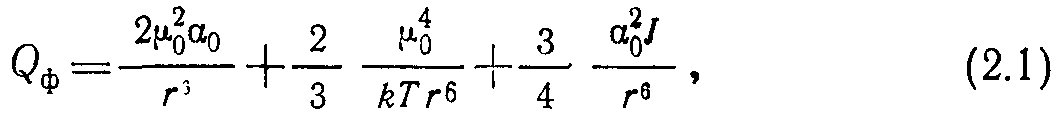
Индукционные, ориентационные и дисперсионные энергии взаимодействия двух одинаковых молекул
|
Газы |
Общая энергия взаимодействия.10, Дж-м8 |
2-1019 |
3 нт |
100 4 |
|||
|
Дж-м* |
% |
Дж-м9 |
% |
Дж-м9 |
% |
||
|
Н2О |
247 |
10 |
4 |
190 |
77 |
47,0 |
19,0 |
|
со |
67,6 |
57-10-3 |
8,5-10-2 |
34-Ю-4 |
5-Ю-3 |
65,7 |
99,9 |
|
NH3 |
187 |
10 |
5,35 |
84 |
45 |
93,0 |
49,6 |
|
HJ |
384 |
1,68 |
0,44 |
35-Ю-2 |
9-Ю-2 |
382 |
99,5 |
|
N2 |
57,2 |
— |
— |
— |
57,2 |
100 |
|
|
о2 |
39,8 |
— |
—. |
— |
—— |
39,8 |
100 |
|
н2 |
11,4 |
— |
— |
— |
— |
11,4 |
100 |
|
Не |
1,49 |
—- |
— |
— |
— |
1,49 |
100 |
|
Ne |
7,97 |
— |
_ |
— |
_ |
7,97 |
100 |
|
Аг |
69,5 |
— |
— |
— |
— |
69,5 |
100 |
пропорциональна шестой степени расстояния между взаимодействующими молекулами.
При химическом взаимодействии энергия притяжения Qx объясняется возникновением ковалентной или ионной связи.
Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. При ионной связи осуществляется взаимное электростатическое притяжение противоположно заряженных ионов. Химическая связь в ряде случаев может носить смешанный характер.
Отталкивание объясняется взаимодействием положительно заряженных ядер сближающихся молекл. Энергия отталкивания обратно пропорциональна двенадцатой степени расстояния между молекулами: Q0 = B/r12.
С учетом всех эффектов энергию взаимодействия между двумя молекулами можно записать в виде AQ = Qo—Q<t>—Qx. При AQ = 0 наблюдается положение равновесия, при котором энергии отталкивания и притяжения одинаковы.
Для нахождения энергии взаимодействия молекулы с поверхностью твердого тела необходимо просуммировать энергии взаимодействия молекулы с каждым атомом кристаллической решетки твердого тела. Если расстояние между молекулой газа и поглощающей поверхностью велико по сравнению с расстоянием между атомами адсорбента, то можно применить интегрирование по объему. Энергия взаимодействия молекулы с твердым телом

где па и V — концентрация и объем атомов адсорбента.
После интегрирования составляющая энергии, обеспечивающая физическое притяжение, будет обратно пропорциональна третьей степени, а отталкивание — девятой степени расстояния между молекулой и поверхностью.
При физической адсорбции энергия взаимодействия обычно не превышает 100• 106 Дж/кмоль. Теплота физической адсорбции некоторых газов на углероде представлена в табл. 2.2.
Таблица 2.2
Теплоты физической адсорбции Q, и теплоты испарения Е некоторых газов на углероде
|
Теплоты |
Воздух |
СОг |
нго |
Пары масел |
Н, |
СО |
|
Q,-10“ • Дж/кмоль Е- 10-в Дж/кмоль |
12…20 5,7 |
28… 33 25,3 |
92 45,3 |
90… 100 96 |
9 0,8 |
12,6 6,3 |
Продолжение табл. 2.2
|
Теплоты |
Аг |
сн4 |
n2 |
О2 |
Не |
Ne |
|
Qa-10-’ Дж/кмоль |
14,7 |
18 |
И… 19> |
13… 20 |
2 |
4,2 |
|
£-10_6 Дж/кмоль |
6,5 |
9,2 |
5,6 |
6,8 |
0,008 |
1,8 |
Энергия взаимодействия для хемосорбции значительно больше, чем для физической адсорбции, и лежит в пределах (100… …400)-10е Дж/кмоль. Теплота хемосорбции различных веществ на углероде представлена в табл. 2.3.
Таблица 2.3
Теплоты хемосорбции некоторых веществ на углероде
|
Теплота |
С |
н |
N |
О |
S |
F |
С1 |
Вт |
3 |
|
Qv 10_8 Дж/кмоль |
344 |
415 |
292 |
350 |
259 |
441 |
238 |
276 |
240 |
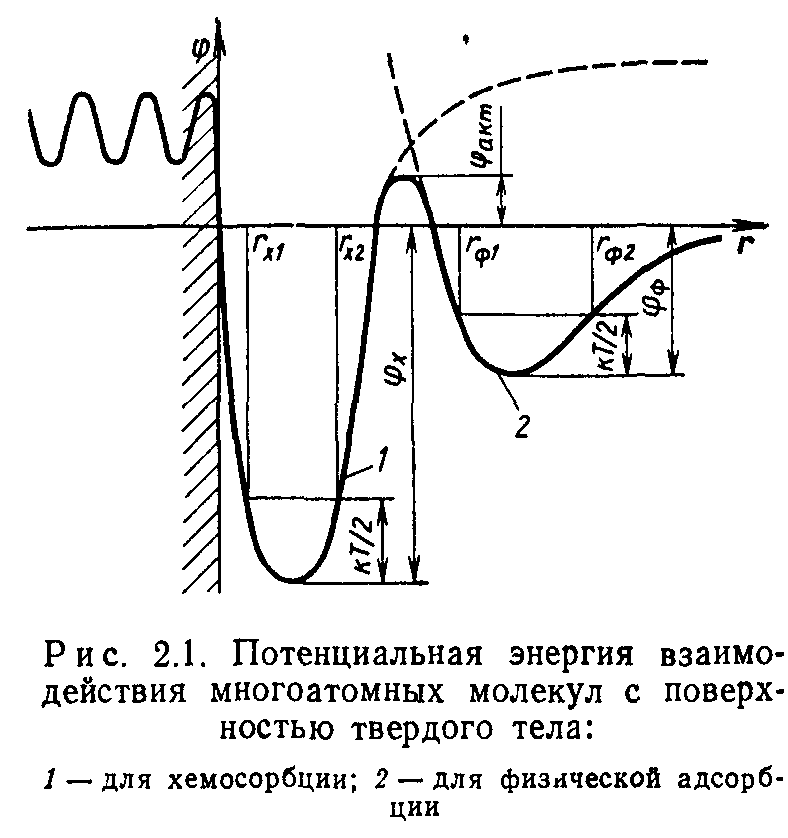
Уравнение (2.2) можно представить в графической форме в виде потенциальных кривых, показанных на рис. 2.1. С приближением к поверхности молекула вначале оказывается в первой потенциальной яме. При этом наблюдается физическая адсорбция. Молекула с энергией поступательного движения kT/2 будет колебаться внутри потенциальной ямы между и Гф2.
Если энергия молекулы более фф+факт, то югоатомная молекула диссоциирует на атомы, которые могут химически взаимодей-
ствовать с поверхностью. При этом атомы попадают во вторую потенциальную яму и колеблются в ней между rxi и гХ2-
Следующим этапом процесса поглощения является абсорбция, которая характеризуется переходом хемосорбированных молекул газа в кристаллическую решетку твердого тела.
Десорбция газа наблюдается в обратном порядке. Молекулы из твердого тела переходят в хемосорбированное состояние, откуда при достаточно высокой энергии молекул /гТ/2>фх+фаКт они могут покинуть поверхность. Для удаления молекул, находящихся в первой потенциальной яме, должно соблюдаться условие kT/2>фф. Для реальных поверхностей с дефектами кристаллической решетки теплота адсорбции не имеет постоянного значения и описывается функцией распределения.
Равновесное количество поглощенного водорода на никелевом порошке при различных температурах показано на рис. 2.2. При повышении температуры от —225 до —175°С количество поглощенного водорода убывает согласно закономерностям физической адсорбции. После минимума при —175°С наблюдается увеличение количества поглощаемого газа, связанного с хемосорбцией. Для удаления хемосорбированного газа в данном случае требуется нагреть адсорбент до температуры 300—400°С.
Теплота адсорбции изменяется при перемещении по поверхности тела. Для идеальных поверхностей эти изменения связаны с периодичностью кристаллической решетки. Величина потенциального барьера при движении молекул по касательной к поверхности называется теплотой миграции. Она связана с теплотой адсорбции следующим соотношением: QM=zQa, где z — коэф-

фициент пропорциональности. Для кубической решетки z=l/2, а для гексагональной — z=2/3.
Реальные соотношения между теплотой адсорбции и теплотой миграции за счет дефектов в решетке могут существенно отличаться от идеальных.