Направленный молекулярный поток, содержащий в начальный момент No молекул газа, за счет столкновений с хаотически движущимися молекулами с частотой К за время dt уменьшается на величину dN=—KNdt. Проинтегрировав это выражение, получим
Здесь L = v/K — средняя длина свободного пути молекул газа, определяемая отношением скорости молекул к числу столкновений в единицу времени; l = vt — длина пути молекулы за время t.
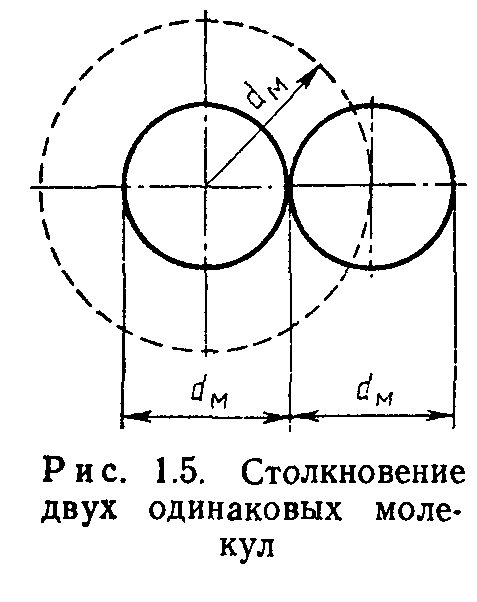
Столкновение молекул произойдет, если расстояние между центрами молекул не более диаметра молекулы dM (рис. 1.5). Будем считать, что одна молекула имеет радиус dM, а все остальные молекулы — математические точки с нулевым радиусом. При движении со скоростью v в газе с молекулярной концентрацией я за 1 с такая воображаемая молекула опишет объем V=ndM2o и испытает K=njidM2v соударений. Средняя длина свободного пути в этом случае
С учетом относительных скоростей движения молекул газа, которые не учитывались при выводе выражения (1.37), для длины свободного пути можно получить более точное выражение

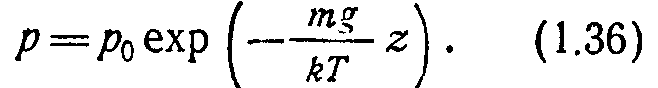



Из формулы (1.38) видно, что при постоянной молекулярной концентрации длина свободного пути не должна зависеть от температуры. Однако из опытных данных следует, что при постоянной молекулярной концентрации с увеличением температуры длина свободного пути увеличивается. Зависимость длины свободного пути от температуры может быть учтена введением в (1.38) дополнительного множителя в знаменателе, получаемого экспериментально:
Здесь С — постоянная Сезерленда, равная температуре, при которой в случае постоянной молекулярной концентрации газа средняя длина свободного пути молекул уменьшается вдвое по сравнению со значением, соответствующим бесконечно большой температуре. Значения постоянной С для различных газов представлены в табл. 1.5.
Таблица 1.5
Характеристики молекул некоторых газов
|
Газы |
m-Ю2’ кг |
</„•10” м |
с, К |
dT’10’° м при t, К |
|||
|
600 |
293 |
77 |
4,2 |
||||
|
n2 |
4,65 |
2,74 |
116 |
2,99 |
3,24 |
4,34 |
14,7 |
|
02 |
5,31 |
3,01 |
125 |
3,31 |
3,60 |
4,88 |
16,7 |
|
Аг |
6,63 |
3,00 |
142 |
3,34 |
3,66 |
5,06 |
17,7 |
|
СО2 |
7,31 |
3,36 |
254 |
4,01 |
4,59 |
6,97 |
26,3 |
|
Ne |
3,35 |
2,35 |
56 |
2,46 |
2,56 |
3,09 |
8,90 |
|
Кг |
19,9 |
3,17 |
188 |
3,63 |
4,06 |
5,88 |
21,4 |
|
н2 |
0,33 |
2,41 |
84 |
2,57 |
2,73 |
3,48 |
11,0 |
|
Хе |
21,8 |
3,53 |
252 |
4,21 |
4,81 |
7,30 |
27,6 |
|
Н2О |
2,99 |
2,53 |
659 |
3,66 |
4,56 |
7,82 |
31,8 |
|
Воздух |
4,81 |
3,13 |
112 |
3,41 |
3,68 |
4,90 |
16,5 |
|
Не |
0,66 |
1,94 |
80 |
2,07 |
2,19 |
2,77 |
8,69 |
Примечание. Диаметры молекул определены из вязкости газов.
Для учета взаимодействия молекул газа между собой (взаимного притяжения) вводят понятие эффективного диаметра молекулы dT‘.


Эффективный диаметр молекулы уменьшается с увеличением температуры газа.
Формулу (1.39) можно представить с учетом (1.40) в виде
Используя уравнение газового состояния (1.10), выражение (1.40) можно преобразовать:
В табл. 1.6 приведены средние длины свободного пути молекул различных газов.
Таблица 1.6
Средняя длина свободного пути молекул различных газов
при давлении 1 Па
|
Газы |
Z.,-103, м-Па при t, К |
Газы |
Li’103, м-Па при /, К |
||||||
|
600 |
293 |
77 |
4,2 |
600 |
293 |
77 |
4,2 |
||
|
ы2 |
20,8 |
8,67 |
1,26 |
0,0061 |
Н2 |
28,2 |
12,2 |
0,197 |
0,0108 |
|
о2 |
16,9 |
7,02 |
1,00 |
0,0047 |
Хе |
10,5 |
3,93 |
0,448 |
0,0017 |
|
Аг |
16,7 |
6,79 |
0,933 |
0,0042 |
Н2О |
13.9 |
4,38 |
0,391 |
0,0013 |
|
со2 |
11,6 |
4,32 |
0,492 |
0,0019] |
Воздух |
16,0 |
6,72 |
0,995 |
0,0048 |
|
Ne Кг |
30,7 14,1 |
13,9 5,52 |
2,50 0,691 |
0,0165 0,0029 |
Не |
43,6 |
19,1 |
3,13 |
0,0174 |
В случае смеси двух газов, молекулы которых имеют массы и т.2, среднюю длину свободного пути Ц частицы с массой mi
Для воздуха при /=293 К и давлении I Па из (1.4) следует, что Л1=6,7-10-3 м-Па. При любом другом давлении
где р — в Па, L — в м.
При расчетах длины свободного пути молекул газа при различных температурах и постоянном давлении на основании (1.41) можно получить следующее выражение:
где

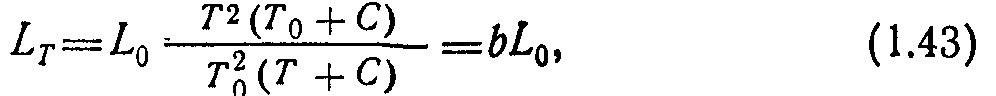

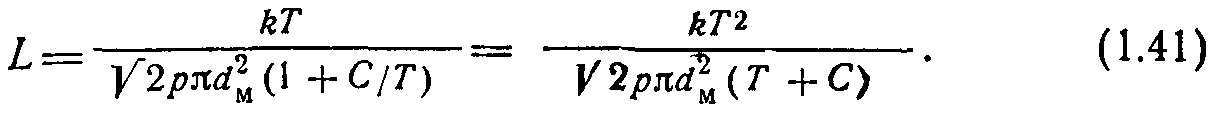

рассчитывают по формуле
Здесь dri — эффективный диаметр молекул с массой mi и концентрацией гц; dn=-^-{dTX—dn)-, dT2 — эффективный диаметр молекулы с массой mi и концентрацией л2.
Первое слагаемое в знаменателе (1.44) зависит от столкновения одинаковых частиц с массой mi, а второе — от столкновения частиц с массами mi и т2. Если Л1<Сп2, то получим более простое выражение: